|
Моно-Н., СН 3 С 6 Н 4 NО 2,
известен во вcех трех изомерных формах. Орто- и пара-Н. получаются в смеси при
нитровании толуола и разделяются фракционированной перегонкой. Нитрование при 55 0
дает выход пара-Н. в 5,5 раз больший, чем орто-Н.; нитрование дымящей HNO 3,
при высших темп. дает тоже преимущественно пара-Н.; серноазотная смесь, даже при
темп. ниже 55°, дает почти 66 % выход орто-Н. Орто-Н. плав. при 10,5°, кип. при
218°, пара-Н. плав. при 54°, кип. при 230°. В технике они применяются для
приготовления соответствующих толуидинов (см.). Мета-Н., плав. при 1 6 °,
кип. при 230°; получается нитрованием ацето-паратолуидида, СН 3.С 6 Н 4.NНСОСН 3
и последующим замещением амидогруппы водородом (К. Buchka, 1889). При дальнейшем
нитровании моно-Н. (орто- и пара-) получаются: [2,4]- ди-Н. с т. пл. 70°,
[2,5]- ди-Н. с т. пл. 48° и [2,4,6]-три - Н.,
с т. пл. 82°. При дальнейшей нитрации моно-мета-Н. получаются [3,4]-ди-Н., с т.
пл. 61° и [3,5]-ди-Н. с т. пл. 92°. Тетра-Н. и пента-Н. пока не получены.
П. Гр.
В технике ди-Н .
(2,4) Haü ssermann рекомендует
приготовлять, приливая к 100 ч. пара-Н. тонкой струей и при непрерывном
размешивании смесь, составленную из 75 ч. крепкой (91 —
92 %) азотной кислоты и 150 ч. серной кислоты (95 —
96 %), при 60 — 65° и затем
нагревая в течение 1/2 часа при 80°; по охлаждении удаляют избыток кислот и
продукт промывают водой, после чего он является в виде однородной
кристаллической (иголочки) массы, плавящейся около 71° и кипящей, отчасти
разлагаясь, при 300°, растворимой в спирте и кипящей воде и нерастворимой в воде
на холоде. Обычный в продаже ди-Н.
(т. пл. 60 — 64°) получается
непосредственным нитрованием толуола. Для приготовления три-Н. лучше
всего, по Ha ü ssermann'y,
исходить из чистого 2,4-ди-Н., полученного по вышеописанному. Растворив его в 4
ч. по весу 95 — 96 % серной
кислоты при легком подогревании, прибавляют затем на холоде 1,5 ч. азотной
кислоты (90° — 92 %) и
нагревают, по временам помешивая, до 90 —
95° в течение 24 час. до полного прекращения выделения газообразных продуктов.
По охлаждении отделяют избыток кислот, промывают продукт сперва горячей водой, а
затем очень слабым раствором соды, и наконец, полученный белый кристаллич.
продукт перекристаллизовывают из спирта, после чего он является в виде
блестящих, бесцветных кристаллов с т. пл. 81,5°. Выход, считая на моно-Н.,
составляет 150 %. Три-Н.
почти нерастворим в горячей воде; сам по себе совершенно не изменяется при 50°,
но отчасти разлагается при действии слабых растворов едких и углекислых щелочей;
от нагревания на воздухе не взрывается, от сильного даже удара взрывается
большей частью не сполна и энергично детонирует от гремучертутного запала.
Бихель (1905) сообщает след. данные о детонации три-Н.: плотн. заряж. —
1,55; теплота разлож. на 1 кг. —
599 Cal.; об. газов по непоср. измер. —
850 лтр. на 1 кг.; вес их 0,960 кг.; об. тв. ост. —
0,018 лтр.; темп. — 2142°;
скорость детонации — 7618
мтр. в сек.; живая сила удара —
2957896 сек.-кг.-мтр.; давл. —
12384 кг. на кв. сн.; давл. при плотн. зар. 1/150 по непоср. измер. —
48,1 кг. на кв. с. (вычисл. 51,78). Три-Н. в настоящее время употребляется во
взрывчатых составах с аммиачной селитрой вместо динитробензола, входит в состав
пластоменитов, тонита № 2 и др., а также с выгодой применен (Wohler) для замены
части гремучей ртути в запальных капсюлях. Предложен также, как самостоятельное
взрывчат. вещество, для замены мелинита, перед которым имеет преимущество по
своей нейтральности и меньшей чувствительности к удару при достаточной силе.
Ди-Н. тоже употребляется в составе пластоменитов и (в Германии) как примесь к
мелиниту в колич. 5—10% для сообщения ему большей легкоплавкости и плотности.
П. П. Р.
|
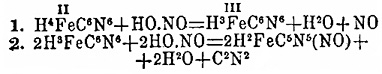
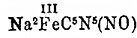 получен (К. А.
Гофман, 1895) амидопруссидный натрий
получен (К. А.
Гофман, 1895) амидопруссидный натрий
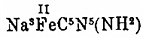 , который
кристаллизуется с 2 1/2H2 O
в виде янтарно-желтых призм; окислителями и при действии NO и HNO 2
эта соль превращается обратно в Na 2C5N5 (NO).
Нитропруссидный натрий есть реактив на сернистые калий, натрий и пр. (но не на
сероводород — нужно прибавить NaOH или NH 3),
и притом очень чувствительный — растворы окрашиваются в красивый пурпурово-синий
цвет; окрашивание очень непостоянно.
, который
кристаллизуется с 2 1/2H2 O
в виде янтарно-желтых призм; окислителями и при действии NO и HNO 2
эта соль превращается обратно в Na 2C5N5 (NO).
Нитропруссидный натрий есть реактив на сернистые калий, натрий и пр. (но не на
сероводород — нужно прибавить NaOH или NH 3),
и притом очень чувствительный — растворы окрашиваются в красивый пурпурово-синий
цвет; окрашивание очень непостоянно.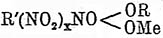
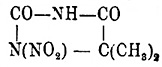 получена
Франшимоном и Клобби нитрованием диметилгидантоина; она представляет тонкие
иглы, трудно растворимые в воде и бензоле, легко растворимые в спирте и эфире;
темп. плавл. 141°С; при кипячении с водой образуется
α - оксиизомасляная
кислота. Динитроэтиленмочевина —
получена
Франшимоном и Клобби нитрованием диметилгидантоина; она представляет тонкие
иглы, трудно растворимые в воде и бензоле, легко растворимые в спирте и эфире;
темп. плавл. 141°С; при кипячении с водой образуется
α - оксиизомасляная
кислота. Динитроэтиленмочевина —
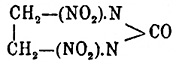 получена
Франшимоном и Клобби действием азотной кислоты на этиленмочевину; призмы,
плавящиеся при 210°; при кипячении с водой она выделяет углекислоту и образует
этилендинитрамин — C 2H4(NH2NO2)2,
плав. при 174° (см. Нитроамины). Кроме перечисленных представителей Н. известны
еще многие другие. Для всех характерна способность приобретать, при действии,
напр., амальгамы натрия или цинка в присутствии кислоты, сильновосстановительные
свойства, что объясняется переходом их в производные гидразина (см.
Нитромочевина).
получена
Франшимоном и Клобби действием азотной кислоты на этиленмочевину; призмы,
плавящиеся при 210°; при кипячении с водой она выделяет углекислоту и образует
этилендинитрамин — C 2H4(NH2NO2)2,
плав. при 174° (см. Нитроамины). Кроме перечисленных представителей Н. известны
еще многие другие. Для всех характерна способность приобретать, при действии,
напр., амальгамы натрия или цинка в присутствии кислоты, сильновосстановительные
свойства, что объясняется переходом их в производные гидразина (см.
Нитромочевина).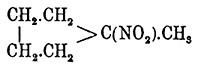 )
получен Марковниковым и М. Коноваловым нитрованием порции нафтенов, кип. 69—71°
и в которой может содержаться метилпентаметилен, кипящий при 72° (М. Коновалов).
C 6H11NO2
жидкость, кип. 179—180°. Описан еще другой нитрогексанафтен — С 6H11 NО 2,
полученный Марковниковым и Муравьевым при нитровании углеводородов с темп. кип.
79—80°, выделенных фракционировкой из бензина (нефтяного); часть образующихся
при этом нитропродуктов, не растворимая в едкой щелочи и представляющая,
следовательно, третичное нитротело, кип. при 197—200° и при восстановлении дает
амин, кип. 132—134°, который авторы считают тожественным с гексаметиленамином,
полученным Байером.
)
получен Марковниковым и М. Коноваловым нитрованием порции нафтенов, кип. 69—71°
и в которой может содержаться метилпентаметилен, кипящий при 72° (М. Коновалов).
C 6H11NO2
жидкость, кип. 179—180°. Описан еще другой нитрогексанафтен — С 6H11 NО 2,
полученный Марковниковым и Муравьевым при нитровании углеводородов с темп. кип.
79—80°, выделенных фракционировкой из бензина (нефтяного); часть образующихся
при этом нитропродуктов, не растворимая в едкой щелочи и представляющая,
следовательно, третичное нитротело, кип. при 197—200° и при восстановлении дает
амин, кип. 132—134°, который авторы считают тожественным с гексаметиленамином,
полученным Байером.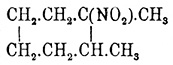 , кип. (при 40
мм) около 123—126°, и вторичное; третичное дает амин — C 3H15NH2,
кип. при 160°, уд. в. 0,8580, а вторичное — амин, кип. 167—169° (Марковников и
Тацитов). Октонафтен (гексагидрометаксилол) образует тоже два
нитропродукта — C 8H15NO2:
третичный
, кип. (при 40
мм) около 123—126°, и вторичное; третичное дает амин — C 3H15NH2,
кип. при 160°, уд. в. 0,8580, а вторичное — амин, кип. 167—169° (Марковников и
Тацитов). Октонафтен (гексагидрометаксилол) образует тоже два
нитропродукта — C 8H15NO2:
третичный
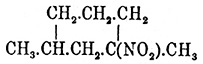 , обладающий
мятным (?) запахом, кип. (40 мм) при 121—122° и при восстановлении цинком с
уксусной кислотой образующий кетон (?), нафтилен и амин C 8H15NH2
(85% теории), кип. 153—154°; амин при обработке соляной кислотой и
азотисто-натриевой солью дает: третичный алкоголь, кип. 167—169°, нафтилен и
кетон (?). Вторичный нитропродукт —
, обладающий
мятным (?) запахом, кип. (40 мм) при 121—122° и при восстановлении цинком с
уксусной кислотой образующий кетон (?), нафтилен и амин C 8H15NH2
(85% теории), кип. 153—154°; амин при обработке соляной кислотой и
азотисто-натриевой солью дает: третичный алкоголь, кип. 167—169°, нафтилен и
кетон (?). Вторичный нитропродукт —
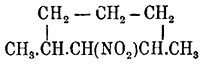 (?) — кипит
около 124—127° (давл. 40 мм) и дает амин, кип. при 158—160°; кетона при этом
образуется мало (?) (Марковников и Крупин). Нононафтен
(гексагидропсевдокумол) дает: третичное нитросоединение
(?) — кипит
около 124—127° (давл. 40 мм) и дает амин, кип. при 158—160°; кетона при этом
образуется мало (?) (Марковников и Крупин). Нононафтен
(гексагидропсевдокумол) дает: третичное нитросоединение
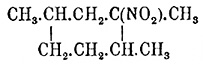 (?), кип. ок.
129° (давл. 40 мм), дающее амин (наряду с кетоном?), способный образовывать
кристаллическую (из петролейного эфира) хлористо-водородную соль и вторичное
(?), кип. ок.
129° (давл. 40 мм), дающее амин (наряду с кетоном?), способный образовывать
кристаллическую (из петролейного эфира) хлористо-водородную соль и вторичное
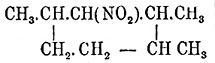 , кип.
130—132° (давл. 40 мм), растворимое в KHO,
дающее при действии брома на этот раствор монобромопродукт, а при восстановлении
оловом с соляной кислотою образующее амин C 9H17NH2,
кип. 175—177°, хлористо-водородная соль которого не кристаллизуется (М.
Коновалов).
, кип.
130—132° (давл. 40 мм), растворимое в KHO,
дающее при действии брома на этот раствор монобромопродукт, а при восстановлении
оловом с соляной кислотою образующее амин C 9H17NH2,
кип. 175—177°, хлористо-водородная соль которого не кристаллизуется (М.
Коновалов).